
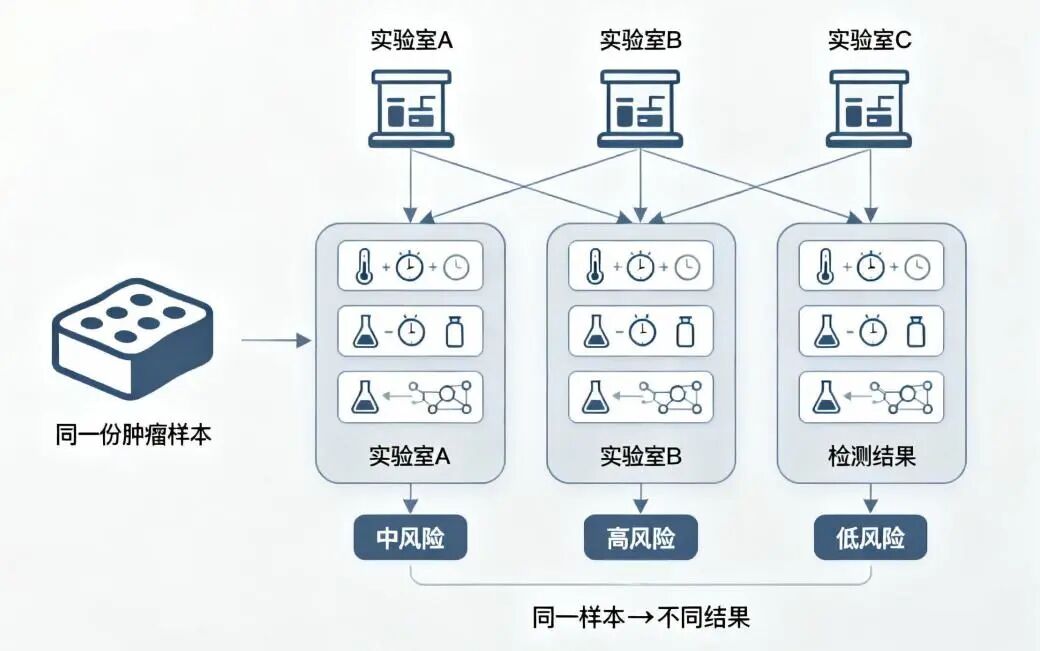
在早期肺癌复发预测的探索中,ctDNA 与 mRNA 模型曾带来新的可能。但随着临床应用的深入,一个现实问题逐渐显现:在Ⅰ期术后这一关键阶段,预测结果的稳定性仍然不足。
当检测信号时有时无、结果在不同时间点或不同平台间出现偏差,我们不得不重新思考:
什么样的分子信息,才能真正支撑影响治疗路径的重要决策?

走进任何一家三甲医院的肿瘤科,类似的对话并不罕见:
“医生,我三个月前 ctDNA 还是阴性,为什么这次复查就复发了?”
“这份 mRNA 报告,和我们医院之前做的结果差异怎么这么大?”
这些困惑,正指向Ⅰ期肺癌复发预测中最棘手的现实挑战——分子检测在低肿瘤负荷状态下的稳定性问题。
① ctDNA:灵敏,却高度依赖“释放条件”的信号
● 原理
ctDNA 检测血液中肿瘤细胞释放的 DNA 片段,是液体活检的重要形式。
● 理想状态
无创、可重复、可动态监测。
但在Ⅰ期术后场景中,面临多重限制:
01 释放量高度波动
早期肺癌的 ctDNA 本就处于检测下限,其释放受肿瘤体积、血供、微环境等多因素影响,导致结果在不同时间点呈现明显波动。
02 空间代表性不足
部分具有侵袭潜能的病灶,可能因局部结构致密而几乎不向血液释放 ctDNA;血液“阴性”,并不等同于生物学“低风险”。
03 时间维度存在滞后
ctDNA 多在细胞凋亡或坏死后进入循环,往往反映的是已经发生的生物学事件,而非尚未显现的风险状态。
● 临床现实
在Ⅰ期术后人群中,ctDNA 更适合作为复发发生后的监测工具,而非稳定的事前风险评估手段。
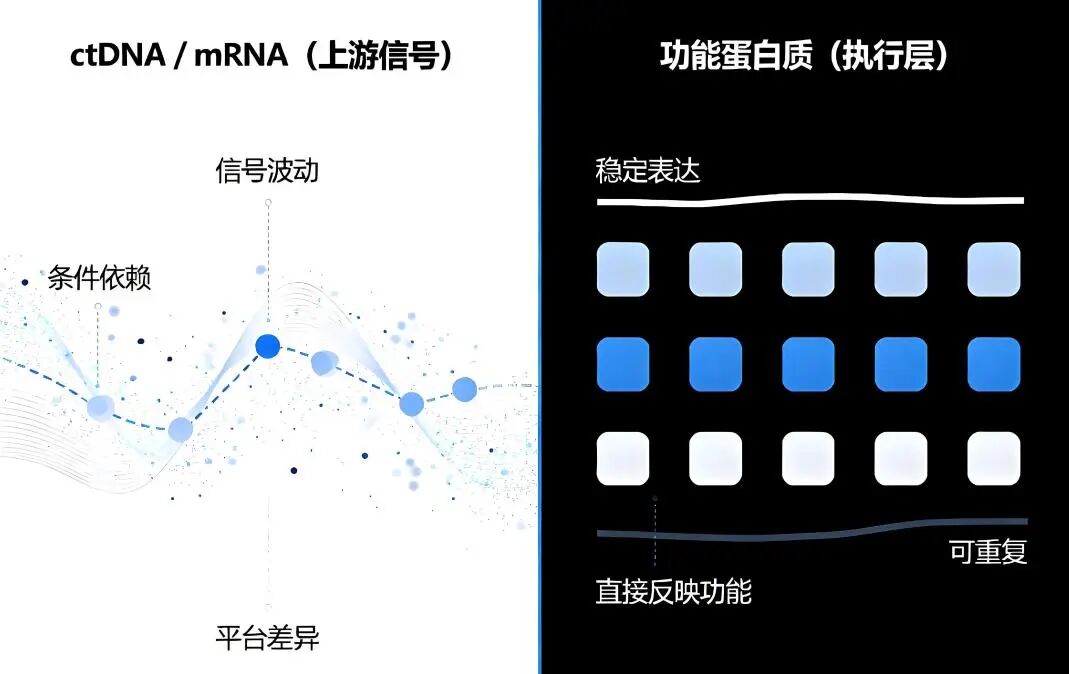
② mRNA:接近机制,却远离执行端
● 原理
mRNA 反映基因转录水平,理论上比 DNA 更接近功能层面。
但在临床实践中:
01 分子本身高度不稳定
样本处理、保存条件、平台差异,均可能对结果造成显著影响,不同实验室之间的可比性有限。
02 转录 ≠ 翻译 ≠ 功能
高 mRNA 表达并不必然意味着蛋白功能增强:
● 翻译可能未发生
● 蛋白可能快速降解
● 关键修饰状态未被激活
因此,mRNA 更像是“中间指令”,而非最终执行结果。
03 亚型适用范围有限
现有多数 mRNA 模型主要建立于肺腺癌队列,对鳞癌患者的指导价值有限。
③ PT-L1™:直接评估“是否已经具备复发能力”
PT-L1™ 并未沿用“上游信号”路径,而是直接切入生命活动的执行层——功能蛋白质。
核心差异对比(临床视角)——

④ PT-L1™ 如何保证结果“可用、可信”
01 绝对定量,避免扩增偏差
基于 LC-MS/MS,对 15 个关键功能蛋白进行绝对定量,避免 PCR 扩增带来的指数级放大误差。
02 FFPE 友好,提高临床可行性
仅需常规术后 FFPE 组织,样本需求量显著降低,更贴近真实临床流程。
03 全流程质控,控制变异
通过多重质控体系,确保检测在体系内具有良好的重复性(批内/批间 CV 控制在可接受范围)。
⑤ 为什么“蛋白质层”更适合Ⅰ期风险预测?
● 它是生物学行为的执行端
● 整合了基因、转录、修饰与微环境信息
● 与临床结局具有更直接的因果关联
在肿瘤负荷极低、信号稀薄的Ⅰ期术后阶段,稳定性,本身就是预测价值的一部分。
ctDNA 与 mRNA 在特定场景下具有不可替代的意义,但在Ⅰ期肺癌术后复发预测这一“低信号、高决策权重”的场景中,其稳定性仍存在天然限制。
PT-L1™并非简单替代,而是补上了这一关键空白——用更稳定的执行层信息,支撑更早、更可信的风险判断。
因为在早期肺癌管理中,每一次判断,都会影响随访节奏、治疗选择,甚至患者未来数年的生活轨迹。而这样的判断,必须建立在最可靠的证据之上。