
编者荐语:
近日,由中国医学科学院肿瘤医院赫捷院士牵头的一项1B期临床研究发表在JTO杂志,为非小细胞肺癌(NSCLC)的新辅助免疫治疗提供了新证据。天津医科大学总医院徐嵩教授分享了对最新进展的分析与思考。
以下文章来源于医脉通肿瘤科 ,作者医脉通

免疫检查点抑制剂改变了晚期恶性实体瘤的治疗指南,然而免疫检查点抑制剂在新辅助治疗的证据尚不充分。近日,由中国医学科学院肿瘤医院赫捷院士牵头的一项1B期临床研究发表在JTO杂志,为非小细胞肺癌(NSCLC)的新辅助免疫治疗提供了新证据。
天津医科大学总医院徐嵩教授分享了对最新进展的分析与思考。
► 专家说

徐嵩 教授
天津医科大学总医院肺部肿瘤外科 副主任医师、副教授、
硕士研究生导师
天津市肺癌研究所 副所长、党支部书记
天津市肺癌转移与肿瘤微环境重点实验室 副主任
比利时布鲁塞尔自由大学,医学博士
AATS Thoracic Surgery Training Fellowship 获得者
ASCO Virtual Mentoring Program获得者 •Mayo Clinic, MGH, UCM和TGH 临床访问学者
天津特聘教授 青年学者
天津市高校“中青年骨干创新人才”
天津市卫生计生行业高层次人才“青年医学新锐”
天津市创新人才推进计划 “青年科技优秀人才”
天津市“131创新型人才工程”第二层次人选 •CSCO“35位35岁以下最具潜力肿瘤医生” /CSCO“35under35岁”成长之星奖
天津医科大学总医院“十佳医生”
2020年天津市科学技术进步奖一等奖
2020年中华医学科技奖医学科学技术奖三等奖
2015年度中国抗癌协会科技奖 三等奖
徐嵩教授:
近年来,以PD-1/PD-L1为代表的免疫检查点抑制剂在非小细胞肺癌(NSCLC)的治疗中取得了极大进展,并且逐步应用于NSCLC的新辅助治疗。信迪利单抗是我国自主研发的PD-1抑制剂,已在多个癌种中展现出了较好的疗效。在这项由赫捷院士和高树庚教授发起的研究中,NSCLC的新辅助免疫治疗取得了巨大成功。
此项研究共纳入了40名IA-IIIB期的NSCLC患者,平均随访时间为37.8个月。其3年总体生存(OS)达到了88.5%,3年的无病生存(DFS)率达到了75%,总体的复发率为22.2%。进一步亚组分析显示,PD-L1表达阳性(≧1%)的患者更容易从新辅助免疫治疗中获益,其3年OS率和DFS率分别达到了95.5%和81.8%。与新辅助化疗相比,新辅助免疫治疗表现出更长的OS。此外,这项研究还探索了新辅助免疫治疗的生物标记物。研究表明,尽管统计学上未表现出显著差异,但是PD-L1表达阳性(≧1%)、高肿瘤突变负荷(TMB≧10)以及较好的病理缓解率(MPR and pCR)仍表现出更好的免疫治疗获益趋势。
在目前进行的NSCLC新辅助免疫治疗临床试验中,已有多项研究表明新辅助免疫治疗的效果优于新辅助化疗。在今年的ASCO会议中,Samuel Rosner等人的研究(NCT02259621)证实了Nivolumab新辅助免疫治疗的有效性2。其3年、4年和5年生存率分别达到了85%、80%和80%;其3年、4年和5年无病生存率也达到了65%、60%和60%。Provencio M等人的研究(NADIM)表明3,免疫+化疗新辅助治疗效果明显好于新辅助化疗。其3年OS和PFS分别达到了81.9%和69%。此外,在CheckMate816研究中4,新辅助免疫+化疗组的中位EFS明显长于新辅助化疗组,分别为31.6个月和20.8个月。因此,新辅助免疫治疗(+/-化疗)在NSCLC中是可行的,并且其效果好于新辅助化疗。
尽管新辅助治疗被证明是有效的,但是仍然缺乏足够可靠的生物标记物来预测疗效。Samuel Rosner等人的研究发现,MPR和PD-L1表达阳性与较长的无复发生存期有关2。在NADIM研究中,原发肿瘤获得MPR与ctDNA清除也被证实与更长的DFS相关3。CheckMate816研究也证实MPR可以改善患者的EFS4。因此,PD1/PD-L1的表达、TMB、MPR/pCR以及血液ctDNA水平可能是新辅助免疫治疗的前在生物标记物,但它们的灵敏度与特异度仍需要进一步研究。
目前的临床研究主要以OS或DFS为研究终点,但在新辅助免疫治疗试验中则主要以MPR/pCR作为研究终点。而MPR/pCR已被证明可预测DFS、RFS和EFS等,但与OS的相关性有待进一步证实。在未来的临床试验中,MPR/pCR是否可以替代OS成为一个新的可靠研究终点仍然需要更多研究证实。
现在仍有多项NSCLC新辅助免疫治疗临床试验仍在进行当中,OS与DFS数据仍然不够完善。因此,我们也期待更多研究来证实新辅助免疫治疗的OS获益,为肺癌患者带来更多的治疗选择。
► 原文解析

研究背景
化疗、放疗和手术切除是NSCLC的传统治疗手段。对于II期以上患者,通常在手术切除后进行辅助放化疗以获得更好的治疗效果。尽管辅助治疗提高了生存率,但NSCLC的5年生存率仍不理想。对NSCLC患者进行新辅助免疫治疗,可激活T淋巴细胞攻击肿瘤,并尽可能延长生存时间。此外,新辅助治疗反应可指导后续的辅助治疗选择。既往研究显示,与常规治疗相比,NSCLC患者可从新辅助治疗中获益更多,然而,许多接受新辅助化疗的患者常出现不良事件,如乏力、肺炎和甲状腺功能减退,这限制了新辅助化疗的应用。因此,作为一种临床效果更好、并发症更少的新兴治疗方法,免疫治疗被视为术前治疗多种癌症(包括NSCLC)的主要治疗手段。
在这项研究中,研究者对NSCLC患者进行了为期3年的随访,揭示了新辅助信迪利单抗的安全性和有效性。另外,还评估了亚组患者(或可作为预测因素:PD-L1表达、肿瘤突变负荷、主要病理反应)的疗效。
研究方法
信迪利单抗(200mg,静脉注射)用于IA-IIIB期NSCLC(注册号:ChiCTR-OIC-17013726)患者。治疗后的29~ 43天内进行手术。所有患者在入组时和术前都进行了PET/CT,以评估PD-1抑制剂治疗后的肿瘤代谢情况。同时,研究者对32例符合条件的患者的PD-L1的表达情况进行了探索性分析(图1)。安全性是主要终点。关键次要终点包括总生存期(OS)、无病生存期(DFS)、无事件生存期和主要病理反应。
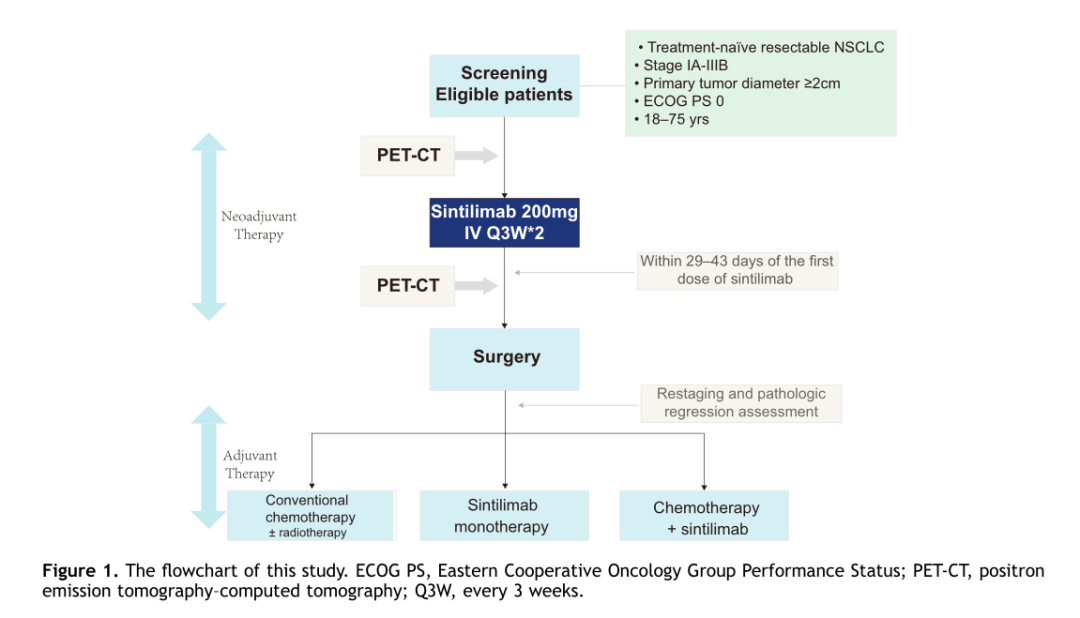
图 1 研究流程图
患者临床特征
2018年3月6日至2019年3月8日期间,共筛查了43例NSCLC患者,最终纳入40例患者。在40例入组患者中,32例(80%)有吸烟史,33例(82.5%)为鳞状细胞癌,8例(20%)为IA期和IB期,14例(30%)为IIA期和IIB期,10例(25%)为IIIA期,8例(20%)有IIIB期(第八版TNM分期)。32例(80%)患者评估了PD-L1表达情况,其中22例(55%)PD-L1表达阳性;37例(92.5%)患者在接受新辅助治疗(2程信迪利单抗)后接受手术治疗。其中36例R0切除(图2),1例R2切除(纵隔淋巴结侵犯)。
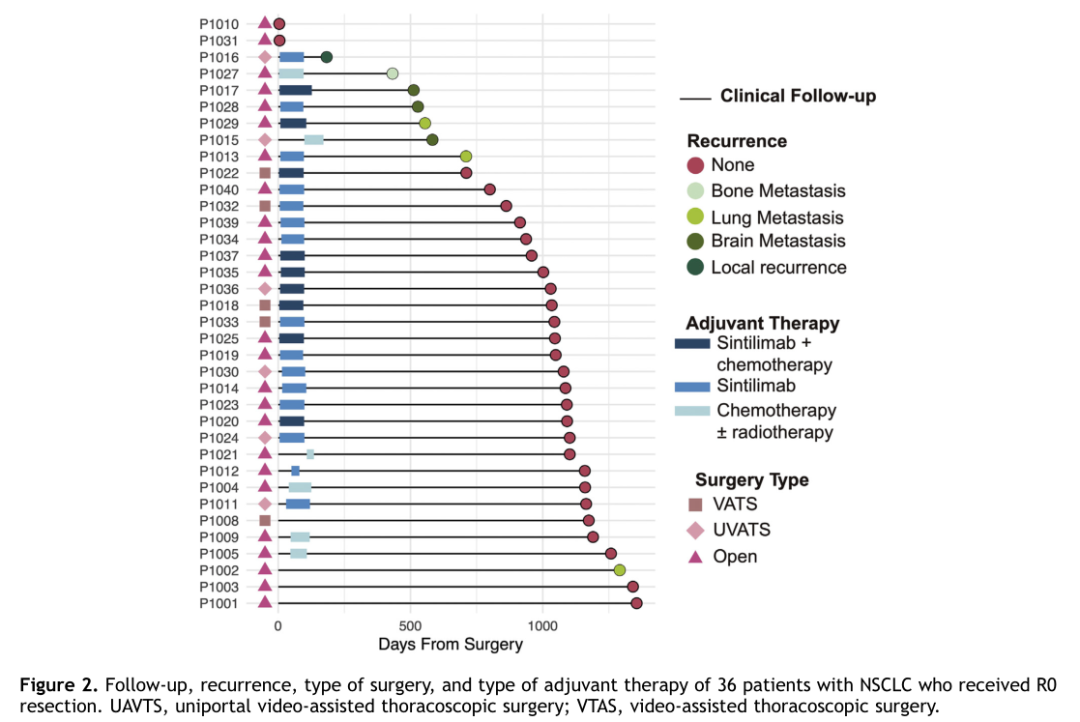
图 2 患者临床信息
复发情况
共8例复发(22.2%),其中局部复发1例,肺转移3例,脑转移3例,骨转移1例。在这8例患者中,1例(12.5%)术后1年内复发,6例(75.0%)术后2年内复发。
生存时间
平均随访时间为37.8个月(1.73~46.5个月)。研究者分析了两个队列患者的生存时间:R0切除患者(36例)和PD-L1表达阳性(TPS≥1%)患者(22例)。在36例R0切除的患者中,3年OS率为88.5%,3年DFS率为75.0% (图3A)。在PD-L1阳性队列中,3年OS率为95.5%,3年DFS率为81.8%(图3B)。
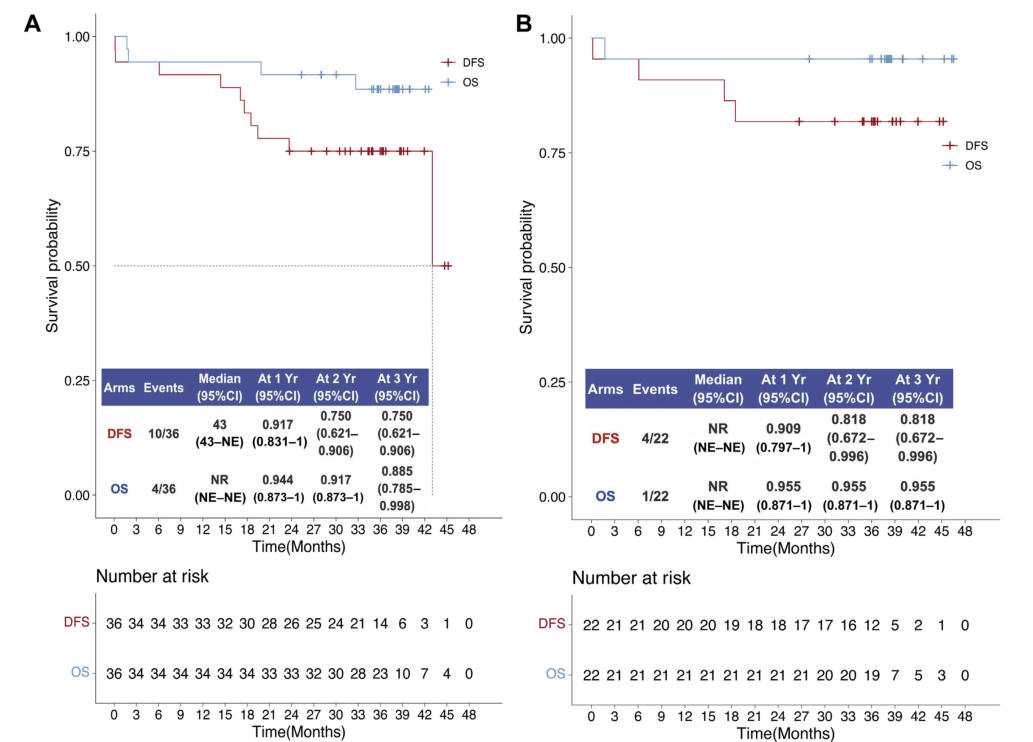
图 3 生存分析
根据PD-L1表达水平,将患者分为高、中、低PD-L1亚组(1%、10%和50%)。DFS分析显示,与PD-L1<1%患者相比,PD-L1≥1%的患者DFS更长(HR=0.275,P=0.0325)(图4A)。但是,以10%和50%为截断值的两个亚组之间没有显著差异(图4B-C)。
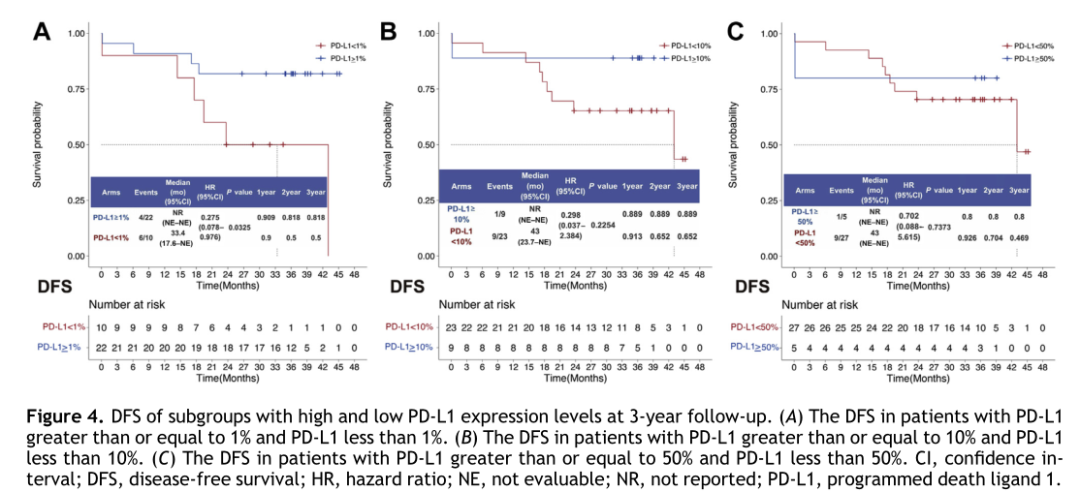
图 4 亚组分析
安全性
分别在32例和21例患者中观察到不良反应(AEs)和新辅助治疗相关的AEs (TRAEs)。2例患者术后短时间内死亡,死亡原因为严重的AE: 1例患者术后第8天死于意识障碍;1例患者术后死于免疫相关肺炎。
结论
基于3年的随访,本研究首次提供了PD-1抑制剂用于NSCLC患者新辅助治疗的长期、全面的生存数据,证明了新辅助信迪利单抗的有效性和可行性,特别是对于PD-L1表达阳性的患者。
参考文献
1. Zhang F, Guo W, Zhou B, et al. Three-Year Follow-Up of Neoadjuvant Programmed Cell Death Protein-1 Inhibitor (Sintilimab) in NSCLC. J Thorac Oncol. 2022;S1556-0864(22)00216-7. doi:10.1016/j.jtho.2022.04.012
2. Samuel Rosner. et al. Neoadjuvant nivolumab in early-stage non–small cell lung cancer (NSCLC): Five-year outcomes. https://meetings.asco.org/abstracts-presentations/208907
3. Mariano Provencio-Pulla. et al. Nivolumab + chemotherapy versus chemotherapy as neoadjuvant treatment for resectable stage IIIA NSCLC: Primary endpoint results of pathological complete response (pCR) from phase II NADIM II trial. https://meetings.asco.org/abstracts-presentations/208906
4. Mariano Provencio-Pulla. et al. Neoadjuvant nivolumab (NIVO) + platinum-doublet chemotherapy (chemo) versus chemo for resectable (IB-IIIA) non-small cell lung cancer (NSCLC): Association of pathological regression with event-free survival (EFS) in CheckMate 816. https://meetings.asco.org/abstracts-presentations/208905