
近日,中南大学湘雅二医院心血管内科团队在中华心血管病网络杂志上发表了一篇题为“High-sensitivity C-reactive protein may be a biomarker of high-density lipoprotein dysfunction and structural remodeling in patients with coronary atherosclerotic heart disease”的文章,文章基于核磁共振波谱技术(NMR),探讨冠心病患者中能反映高密度脂蛋白(high‑density lipoprotein,HDL)介导的胆固醇流出能力(cholesterol efflux capacity, CEC)的指标。文中特别致谢了谱天生物在核磁检测与分析等方面做出的支持。基于核磁共振波谱技术的微量样本无损检测、高通量全程自动化、无与伦比的重现性,独家数据库平台等优势,谱天生物持续在心脑血管疾病的早期预警、用药指导和长期监测方面进行探索研究,推动以更精准的方式实现包括心脑血管、常见癌种等在内的筛查与用药指导。
研究背景
全球疾病负担研究和中国心血管健康与疾病报告显示,以冠心病(coronary atherosclerotic heart disease,CHD)为代表的动脉粥样硬化性心血管疾病仍然是全球范围内的首位死亡原因,且我国CHD的死亡率仍在逐年上升,防治CHD刻不容缓。尽管当前降低低密度脂蛋白胆固醇(low‑density lipoprotein cholesterol,LDL‑C)水平的治疗方法在CHD的防治中取得了显著的获益,但是即使将LDL‑C降低到0.78 mmol/L的低值,仍有约10%的患者发生心血管事件,即仍然存在剩余风险,这敦促我们仍应积极地寻找新的干预靶点。20世纪80年代,多项流行病学研究一致发现高密度脂蛋白(high‑density lipoprotein,HDL)胆固醇(HDLcholesterol,HDL‑C)水平与CHD事件发生率呈负相关,因此,HDL‑C曾被认为是重要的心血管保护因素。但是,接下来的升高HDL‑C的药物临床试验、遗传学研究结果均不支持上述观点。HDL是血浆中一群8~13 nm、异质性很强的脂蛋白颗粒,有介导泡沫细胞胆固醇流出、抗氧化和抗内皮细胞炎症等功能。目前,多项大规模临床试验已证实体外实验测得的HDL胆固醇流出能力(cholesterol efflux capacity,CEC)不仅可以独立预测健康人群的心血管风险,还可以独立预测CHD患者的不良事件发生率和死亡率,有重要的临床价值。但是CEC的测定需要体外细胞模型和同位素,这限制了它在日常临床工作中的使用。因此本研究中我们希望找到能反映CHD患者的CEC的指标。
研究方法
连续纳入2018年6月至7月在中南大学湘雅二医院心血管内科住院且经冠状动脉造影确诊的冠心病患者(CHD组)36例和同期非冠心病患者(非CHD组)61例。采集患者入院次日晨起空腹血,离心全血后获得血浆样本。将血浆样本分装后冻存于-80 ℃冰箱用于CEC和HDL结构的检测。CEC的检测主要有以下5个步骤:以肝素锰沉淀法获得HDL、巨噬细胞荷脂、上调胆固醇流出通道蛋白的表达、胆固醇流出及检测同位素含量。使用核磁共振波谱技术(nuclear magnetic resonance spectroscopy, NMRS)检测HDL的结构。收集研究对象的基线特征、常规生化指标,并检测 CEC 和HDL的结构参数。应用Pearson相关分析寻找与CEC相关的变量,并以多重线性回归分析进一步评价变量与 CEC 的关系。
研究结果
1. 临床特征
CHD组所有患者均诊断为急性冠状动脉综合征,包括4例ST段抬高型心肌梗死,14例非ST段抬高型心肌梗死,18例不稳定型心绞痛。其中,29例患者(80.6%)的采血时间距离发病时间间隔≥7 d。与非CHD组相比,CHD组的患者年龄更大、男性更多,糖尿病、高血压、现况吸烟者更多,血浆总胆固醇、HDL‑C、LDL‑C更低,但hs‑CRP更高[1.76(0.88~4.05)vs. 0.91(0.32~1.87),Z=2.89,P=0.004]。
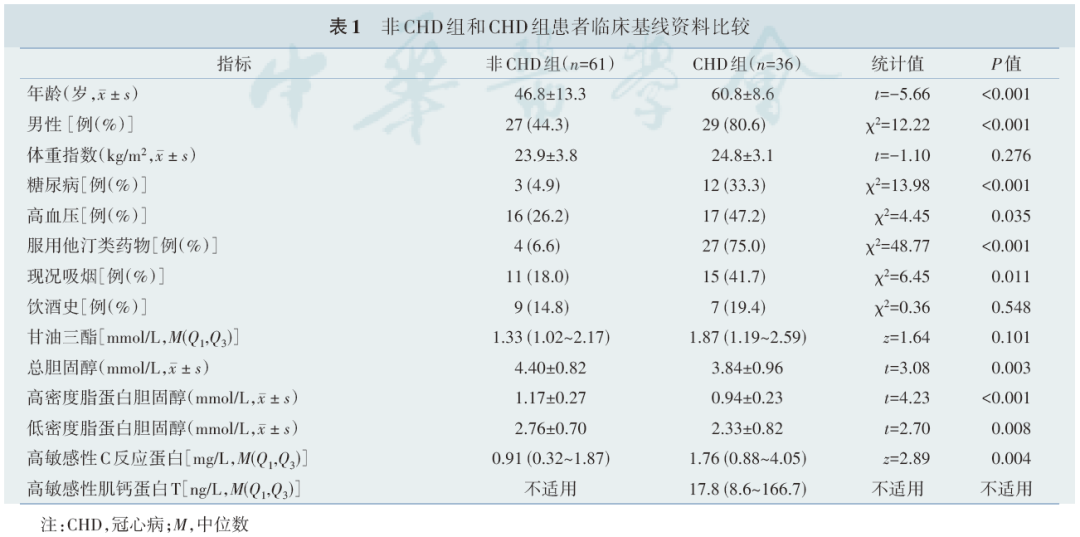
2.高密度脂蛋白胆固醇与胆固醇流出能力的关系
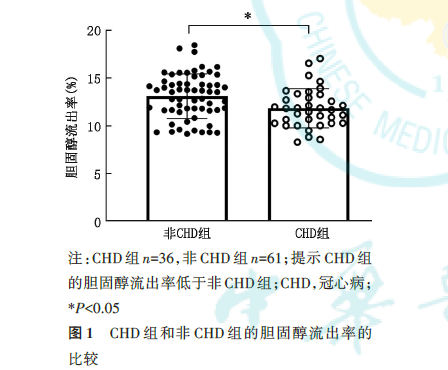
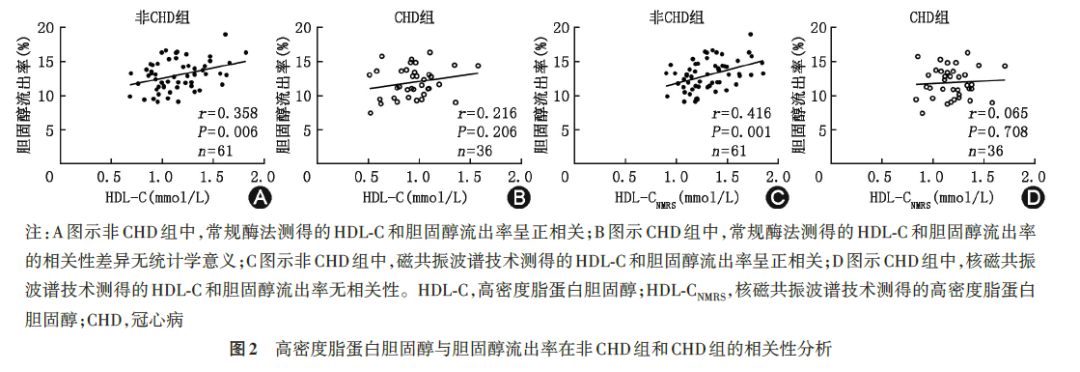
CHD组的CEC低于非CHD组[(11.9%±2.3%)vs.(13.0%±2.2%),t=-2.32,P=0.022,图 1],差异有统计学意义。在非 CAD 组,HDL‑C 与 CEC 正相关(r=0.358,P=0.006,图 2A),但是该相关性在CAD组中差异无统计学意义(r=0.216,P=0.206,图 2B)。NMRS验证了该结果,即HDL‑CNMRS在非CHD组中与CEC呈正相关(r=0.416,P=0.001,图2C),但在CAD组中与CEC无相关性(r=0.065,P=0.708,图2D)。NMRS还同时检测了总HDL和各HDL亚组中的载脂蛋白A‑Ⅰ(apolipoprotein A‑Ⅰ,apoA‑Ⅰ)、apoA‑Ⅱ、磷脂、甘油三酯、游离胆固醇含量。将CEC与以上指标作单变量相关分析,可发现非CHD组中,CEC与总HDL磷脂、总HDL游离胆固醇、总HDL apoA‑Ⅰ、总 HDL apoA‑Ⅱ均呈正相关(P<0.05),但是在CHD组中,上述相关性均消失。
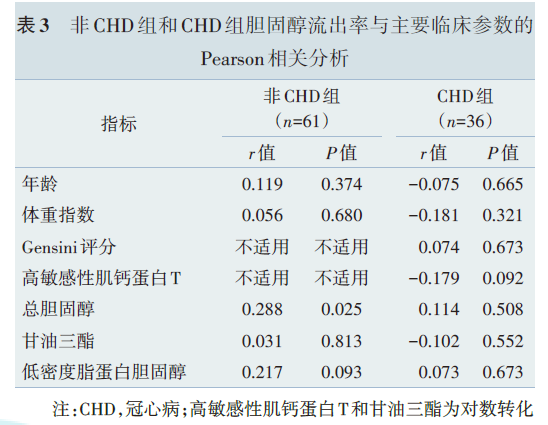
3.冠心病组中影响CEC胆固醇流出能力的因素
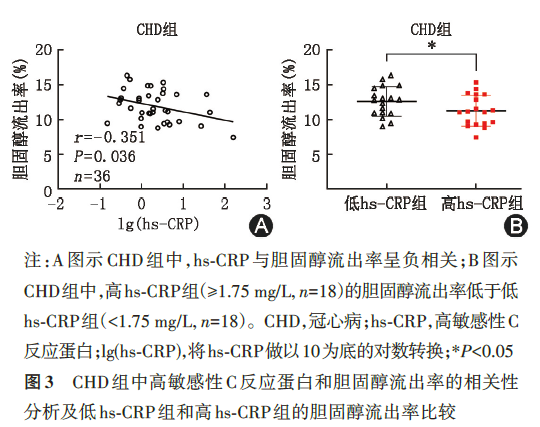
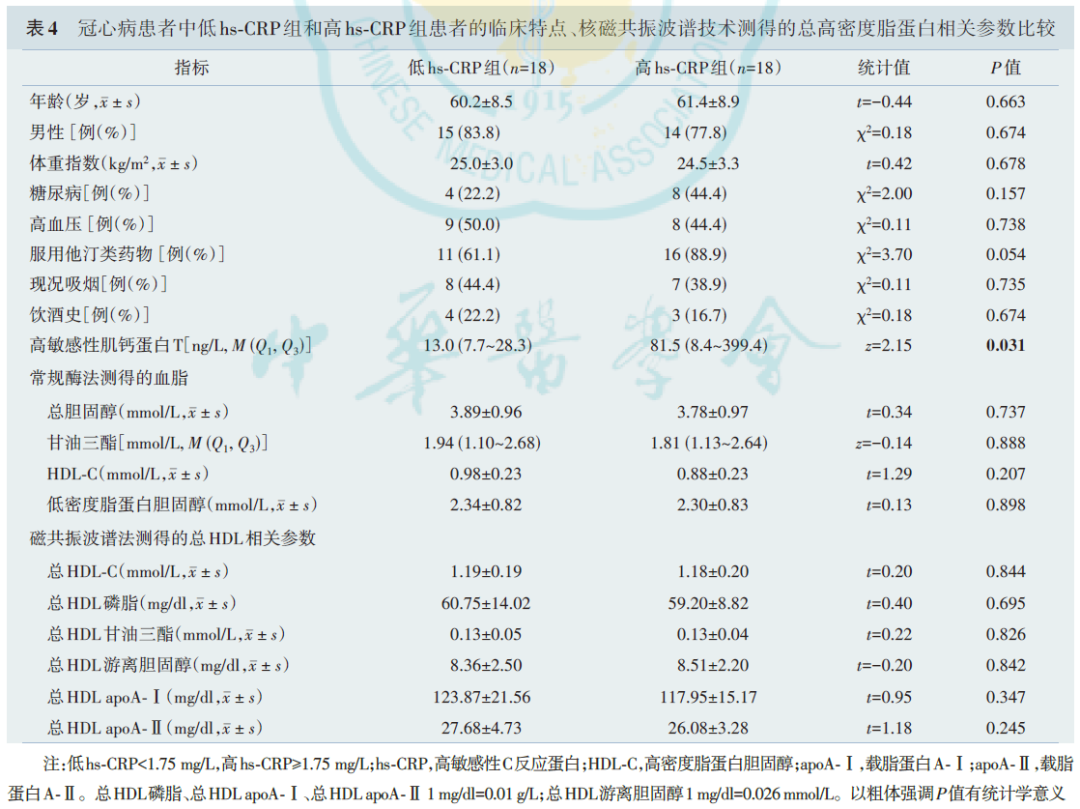
为了探究CHD组中影响CEC的因素,我们将各临床指标与CEC做相关性分析。CEC与患者的年龄、体重指数、冠状动脉病变的严重程度(Gensini评分)、高敏感性肌钙蛋白T、总胆固醇、甘油三酯、低密度脂蛋白胆固醇均无相关性(表3)。但是,CEC和hs‑CRP呈现负相关(r=-0.351,P=0.036,图3A)。将36例CAD患者按hs‑CRP的中位数(1.75 mg/L)分为高hs‑CRP组和低hs‑CRP组。除外高敏感性肌钙蛋白T,两组患者的基线特点、总HDL 中的脂质和载脂蛋白含量均无明显差异(表4),但高hs‑CRP组的CEC低于低hs‑CRP组[(11.3%±2.2%)vs.(12.6%±2.1%),t=-1.83,P=0.038,图3B],差异有统计学意义。
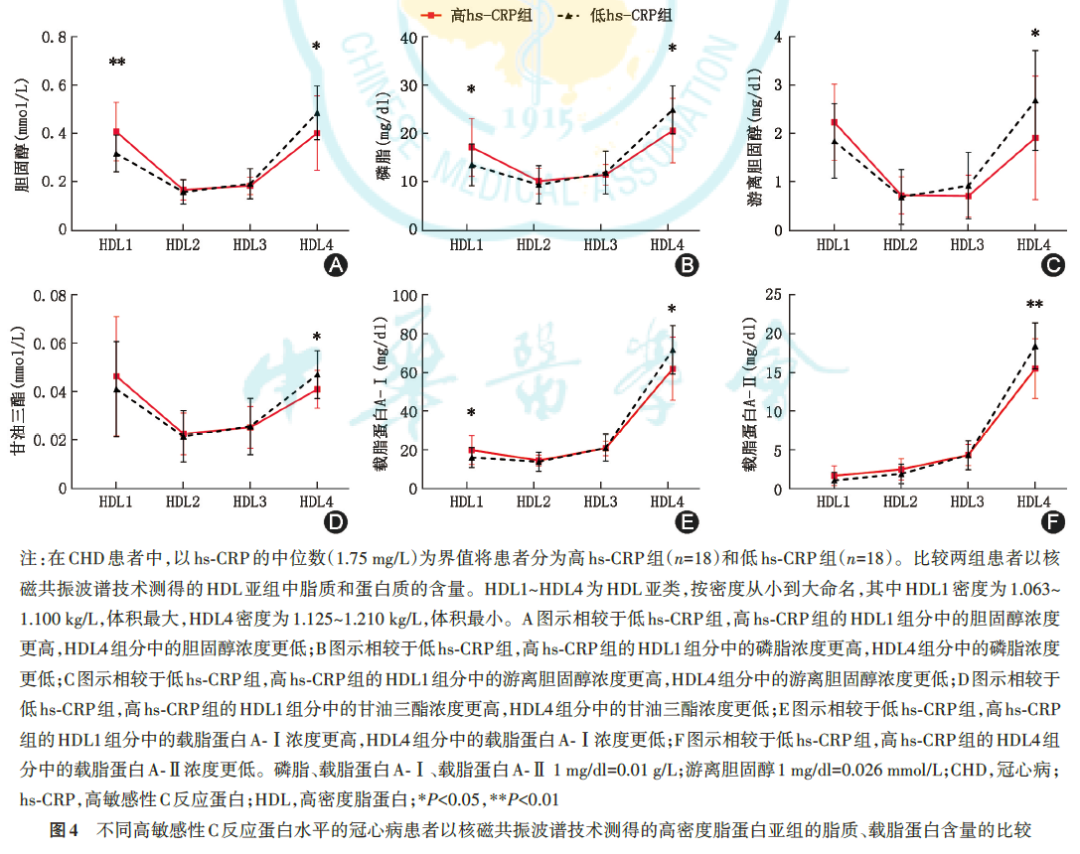
4.冠心病组中高密度脂蛋白的组分
以NMRS检测不同水平hs‑CRP的CHD患者中HDL 的结构。结果显示,与低hs‑CRP组相比,高hs‑CRP组最大的HDL亚组(HDL1)中的脂质、载脂蛋白含量更高,而最小的HDL亚组(HDL4)中的脂质、载脂蛋白含量更低(图4)。相关性分析显示,hs‑CRP与HDL1的脂质和载脂蛋白含量呈正相关,而与HDL4的脂质和载脂蛋白含量呈负相关。
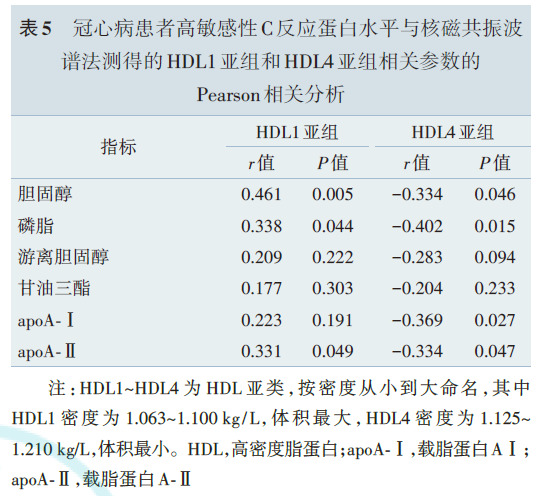
5.多重线性回归分析
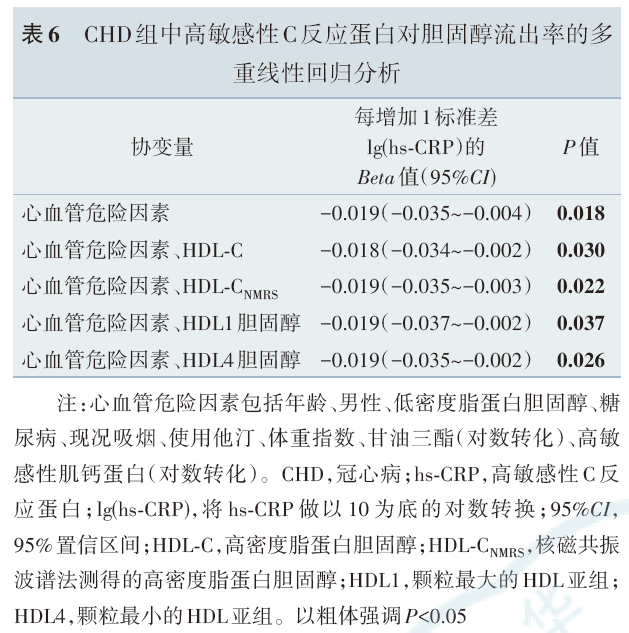
CHD组中,在调整了年龄、男性、低密度脂蛋白胆固醇、糖尿病、现况吸烟、体重指数、甘油三酯、高敏感性肌钙蛋白、使用他汀的基础上,进一步分别控制HDL‑C/HDL‑CNMRS/HDL1胆固醇/HDL4胆固醇,hs‑CRP仍与CEC呈负相关。
讨论
长期以来,HDL‑C被公认为动脉粥样硬化性心血管疾病的保护因素,但大部分以升HDL‑C为目标的药物临床试验,如烟酸及胆固醇酯转运蛋白抑制剂都以失败告终。近来,一项包含43407名健康人,平均随访12.1年的流行病学研究却发现,极高HDL‑C水平(≥2.32 mmol/L)与心血管死亡风险增加有关。这说明仅以HDL‑C水平预测心血管风险是不可靠的。HDL主要通过介导血管内皮下的胆固醇逆转运至肝脏,发挥抗动脉粥样硬化的作用。CEC是基于体外实验测得的指标,可用于评价胆固醇逆转运的起始步骤,即HDL介导胆固醇从细胞内移除的步骤。多项研究已明确CEC是心血管事件的独立保护因素。但是,CEC的测定对实验环境要求高,且耗时耗力。如何能简易地在冠心病患者中对CEC做出评价,是一个值得探索的问题。
本研究在小样本的非CHD和CHD患者中对HDL的功能和结构进行了探索,研究发现:(1)CEC在CHD组低于非CHD组[(11.9%±2.3%)vs(13.0%±2.2%)],差异有统计学意义。在非CHD组中,CEC和HDL‑C呈正相关(酶法:r=0.358,P=0.006;NMRS:r=0.416,P=0.001),但在CHD组中,CEC和HDL‑C无相关性(酶法:r=0.216,P=0.206;NMRS:r=0.065,P=0.708);(2)CHD组中,CEC与hs‑CRP呈负相关(r=-0.351,P=0.036),且该相关性在调整了冠心病危险因素及HDL‑C后仍然存在,说明hs‑CRP是CEC的危险因素;(3)CHD组中,hs‑CRP越高,大颗粒HDL越多,小颗粒HDL越少,说明HDL向大颗粒重塑。
1.冠心病患者的HDL-C流出能力下降
既往已有高质量的研究发现冠心病患者的CEC显著低于健康人,本研究结果与其一致。但是,文献中对于冠心病患者中HDL‑C和CEC的关系却存在争议。HDL‑C和CEC的相关系数在Khera等的研究中为0.51(P<0.0001),而在Zhang等的研究中为-0.09。本研究结果与Zhang等的一致,其原因可能在于:本研究与Zhang等的研究纳入的均是急性冠状动脉综合征的患者,而Khera等纳入的是稳定型冠心病患者和一部分健康人。由此可见,疾病状态影响CEC。除了冠心病,急性炎症、终末期肾脏病、1/2型糖尿病及自身免疫性疾病患者均存在CEC受损。
2.在冠心病患者中,胆固醇流出能力与高敏感性C反应蛋白呈负相关
本研究还观察到,冠心病患者中,伴随CEC的下降,hs‑CRP与CEC呈负相关。此现象和Vaisar等在急性炎症模型中发现的现象十分类似。在该研究中,以小剂量内毒素诱导健康受试者出现急性炎症反应,CEC下降。此时的HDL蛋白质组学揭露出,HDL内的血清淀粉样蛋白A1(serum amyloid A1,SAA1)和SAA2显著升高,且SAA与CEC呈负相关。尽管原因未被完全阐明,但体外实验和SAA1/2基因敲除小鼠模型证实掺入HDL的SAA本身可引起CEC下降。因为冠心病也是一种炎症性疾病,且CRP和SAA类似,均为系统性炎症反应时由肝脏分泌的急性时相蛋白,所以我们推测,本研究中观察到的CEC下降且与hs‑CRP呈负相关的现象可能是由HDL中的SAA增多导致的。另一方面,炎性apoA‑Ⅰ修饰也可损害CEC。本研究中总HDLapoA‑Ⅰ在健康人中与CEC相关,而在冠心病患者中该相关性消失,这提示炎性apoA‑Ⅰ修饰也可能是前述现象的原因之一。虽然炎症在冠心病发生发展中的机制未被完全阐明,但hs‑CRP已是公认的冠心病风险标志物。基线hs‑CRP高(≥2mg/L)的稳定型冠心病患者发生主要不良心血管事件(major adverse cardiovascular events,MACE)的风险显著高于基线hs‑CRP低者。在CANTOS研究中,既往心肌梗死且hs‑CRP≥2mg/L的患者被给予白细胞介素‑1β单克隆抗体——卡那单抗治疗。治疗中hs‑CRP水平降低至2mg/L以下者MACE事件减少25%,而hs‑CRP未达标者则没有显著获益。与之相反,另一种抗炎药物甲氨蝶呤对既往心肌梗死的患者没有获益,而伴随的则是hs‑CRP无显著降低。基于以上结果和本研究的发现,hs‑CRP可作为冠心病风险标志物的原因(至少是原因之一)在于它可以反映HDL功能异常。
3.高敏感性C反应蛋白水平高的冠心病患者高密度脂蛋白向大颗粒重塑
我们的研究还发现,hs‑CRP水平高的冠心病患者,血浆中HDL向大颗粒重塑。这和既往用电泳法区分HDL亚类获得的结果一致。成熟的HDL是由单层磷脂包裹疏水的脂质核心(主要含胆固醇酯和甘油三酯)形成的球形颗粒,表面有载脂蛋白。根据颗粒的大小,HDL可以被二分为大颗粒和小颗粒。流行病学研究发现,在健康人群中,小颗粒HDL和CHD的发病率呈负相关,而大颗粒则无明显相关性。本研究中未对HDL重塑的机制展开深入探究,但值得一提的是,前述的SAA掺入,也可造成剂量依赖性的HDL体积增加。
4.本研究的局限性
本研究存在一定局限性。首先,因为本研究的样品和数据来源于另一项横断面研究,其最初的研究目的不是寻找CEC的标志物,这导致CHD患者的样本量较小。其次,在使用多重线性回归分析时,尽管调整心血管风险因素后,hs‑CRP仍与CEC呈负相关(P<0.05),但此时如果用Bonferroni检验对P值进行校正,则相关性将失去统计学意义,因此我们仍只能得出“可能相关”的结论,还需进一步研究以获得确切的结论。再次,本研究纳入的半数冠心病患者诊断为心肌梗死。心肌梗死患者体内炎症的来源(主要是坏死心肌)有别于稳定型冠心病患者(主要是血管壁或脂肪组织),它们影响HDL功能的机制可能存在差异。未来尚需大规模临床研究,分别探究稳定型冠心病或心肌梗死急性期患者的HDL结构和功能,以进一步验证本结论。最后,本研究虽然推测系统性炎症在HDL结构和功能重塑中发挥重要作用,但我们未深入探究其机制。
研究结果
综上所述,冠心病患者中,HDL‑C不能反映HDL的CEC,但测量hs‑CRP可以实现。hs‑CRP水平越高,HDL的CEC越低,伴随HDL向大颗粒重塑。hs‑CRP可能是冠心病患者HDL功能异常和结构重塑的标志物。而系统性炎症则可能是这些现象背后共同的机制。